9月19日,國際學術期刊Cell Research在線發表了中國科學院分子細胞科學卓越創新中心(生物化學與細胞生物學研究所)劉珈泉研究組聯合中國科學院上海免疫與感染研究所鐘勁研究組的最新研究成果:"ATP-dependent one-dimensional movement maintains immune homeostasis by suppressing spontaneous MDA5 filament assembly"。研究團隊通過單分子熒光成像技術,系統性地揭示了MDA5蛋白作為ATP驅動的分子馬達在雙鏈RNA上進行易位運動的分子機制,闡明了這種獨特的運動方式如何抑制MDA5纖絲狀寡聚體(filament)的組裝以維持免疫穩態,為理解先天免疫調控和自身免疫疾病機制提供了全新視角。
MDA5是RIG-I樣受體(RLR)家族的重要成員,負責識別病毒雙鏈RNA并啟動先天免疫反應,其激活需要沿著雙鏈RNA形成filament狀結構,從而觸發N端CARD結構域的寡聚化。雖然已知MDA5的ATP酶活性對維持免疫穩態至關重要,可能通過調節纖維組裝實現,但其潛在的分子機制一直不清楚。這一問題的解決,將深化我們對先天免疫調控機制的理解。
為探究MDA5的工作機制,研究團隊利用單分子熒光成像技術首次直接觀察并實時追蹤了MDA5蛋白在雙鏈RNA上的動態行為,并結合負染電鏡、生化分析和細胞免疫學實驗等多種方法,深入解析MDA5 filament組裝的調控機制。研究團隊發現,MDA5作為ATP水解驅動的分子馬達,能夠沿著雙鏈RNA進行一維運動。多個MDA5馬達可以協同加載到單條雙鏈RNA上,但它們的運動很少同步,這種不同步的運動有效抑制了自發的filament形成和激活。
更重要的是,研究團隊揭示了LGP2作為MDA5信號傳導關鍵調節因子的新機制。LGP2能夠識別運動中的MDA5馬達并阻止其運動,從而通過"運動阻斷機制"促進microfilament組裝。這種獨特的組裝策略突出了一維運動在高階蛋白寡聚化中的重要作用,并揭示了維持免疫穩態的新穎機制。
這項研究不僅在理論上豐富了我們對先天免疫受體工作機制的認識,還為自身免疫疾病的治療提供了新的靶點。研究團隊對已知與人類自身免疫疾病相關的MDA5 ATP酶缺陷突變體(R337G和M854K)進行了研究,發現這些突變體失去了正常的一維運動能力,導致對自身RNA的異常識別和免疫反應。這一發現為理解相關自身免疫疾病的發病機制提供了關鍵的分子基礎,也為開發針對先天免疫系統精準調控的新型治療策略奠定了重要基礎。
分子細胞卓越中心劉珈泉研究員和中國科學院上海免疫與感染研究所鐘勁研究員為該論文的共同通訊作者。分子細胞卓越中心博士研究生韓曉鵬、博士后饒銘、中國科學院上海免疫與感染研究所博士研究生常鈺為共同第一作者。該工作得到分子細胞卓越中心陳玲玲研究員、侯法建研究員、張少慶研究員的大力支持,以及中國科學院戰略性先導科技專項、國家重點研發計劃、核糖核酸功能與應用重點實驗室和國家自然科學基金的資助。
文章鏈接:https://doi.org/10.1038/s41422-025-01183-8
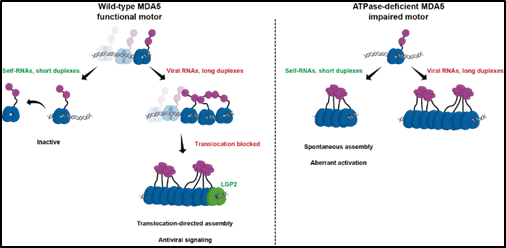
MDA5通過ATP依賴的一維運動維持免疫穩態的分子機制