10月2日,國(guó)際學(xué)術(shù)期刊Molecular Cell在線發(fā)表了中國(guó)科學(xué)院分子細(xì)胞科學(xué)卓越創(chuàng)新中心(生物化學(xué)與細(xì)胞生物學(xué)研究所)許琛琦研究組聯(lián)合中國(guó)科學(xué)院深圳先進(jìn)技術(shù)研究院合成生物學(xué)研究所施小山研究組與上海科技大學(xué)王皞鵬研究組的最新研究成果:"Lipid-regulated phosphorylation hierarchy of the T cell receptor tyrosine motifs"。研究團(tuán)隊(duì)利用核磁共振、定量質(zhì)譜、生化和細(xì)胞實(shí)驗(yàn),解析了TCR-CD3復(fù)合物中關(guān)鍵信號(hào)亞基CD3ζ的胞內(nèi)區(qū)結(jié)構(gòu)以及磷酸化規(guī)律,揭示了脂質(zhì)與正電基序(Basic residue Rich Sequence, BRS)靜電相互作用在其中的關(guān)鍵調(diào)控機(jī)制,同時(shí)提出CD3ζ磷酸化不充分是T細(xì)胞功能耗竭的誘因之一。
T細(xì)胞的活化依賴其表面T細(xì)胞受體(TCR)對(duì)抗原的精準(zhǔn)識(shí)別及后續(xù)信號(hào)傳遞。TCR信號(hào)如何實(shí)現(xiàn)“精準(zhǔn)啟動(dòng)”與“功能多樣性”,是免疫學(xué)領(lǐng)域的核心科學(xué)問題之一。TCR結(jié)構(gòu)復(fù)雜,由抗原識(shí)別亞基TCRαβ和三個(gè)信號(hào)亞基CD3εδ、CD3εγ和CD3ζζ構(gòu)成。這些CD3信號(hào)鏈的胞內(nèi)區(qū)共含有10個(gè)免疫受體酪氨酸活化基序(ITAM),對(duì)應(yīng)20個(gè)可磷酸化的酪氨酸位點(diǎn)。這些位點(diǎn)如何通過差異磷酸化編碼特異性抗原信號(hào),仍是未解之謎。盡管近期多項(xiàng)冷凍電鏡研究報(bào)道了TCR-CD3復(fù)合體結(jié)構(gòu),但由于CD3胞內(nèi)區(qū)無序且高度動(dòng)態(tài),其構(gòu)象信息仍嚴(yán)重缺失。因此,解析該區(qū)域的結(jié)構(gòu)與功能,對(duì)完整理解TCR介導(dǎo)的免疫應(yīng)答至關(guān)重要。
CD3ζζ同源二聚體是TCR-CD3復(fù)合物的關(guān)鍵信號(hào)亞基,其每條胞內(nèi)區(qū)含有3個(gè)ITAM,由此貢獻(xiàn)了TCR中60%的可磷酸化酪氨酸位點(diǎn)。為攻克CD3ζ胞內(nèi)區(qū)“無序且動(dòng)態(tài)”帶來的結(jié)構(gòu)解析難題,研究團(tuán)隊(duì)采用模擬生理膜酸性磷脂環(huán)境的脂質(zhì)雙分子層(bicelle)系統(tǒng),結(jié)合溶液核磁共振技術(shù),成功解析了CD3ζ胞內(nèi)信號(hào)區(qū)的動(dòng)態(tài)構(gòu)象。結(jié)構(gòu)分析表明,CD3ζ的3個(gè)ITAM基序呈現(xiàn)從N端到C端的膜插入梯度:N端的ITAM1膜插入程度最淺,ITAM2居中,ITAM3最深。值得注意的是,ITAM的膜插入水平主要由其鄰近的BRS與脂質(zhì)的相互作用調(diào)控,而非ITAM自身序列。這一發(fā)現(xiàn)明確了CD3ζITAM結(jié)構(gòu)異質(zhì)性的分子基礎(chǔ)。
為探究ITAM膜插入差異的功能影響,研究團(tuán)隊(duì)利用新型靶向定量質(zhì)譜等技術(shù)分析了其磷酸化模式。發(fā)現(xiàn)在酸性脂質(zhì)環(huán)境中,ITAM磷酸化效率與其膜插入深度呈負(fù)相關(guān),即膜插入最淺的ITAM1最易被LCK激酶接觸,故磷酸化最快,形成從N端到C端的順序磷酸化;此順序在中性脂質(zhì)環(huán)境或BRS突變體中均消失,證明“BRS-lipid”的靜電相互作用是CD3ζ順序磷酸化的核心驅(qū)動(dòng)因素。
研究團(tuán)隊(duì)進(jìn)一步探究了慢性TCR刺激(模擬腫瘤微環(huán)境或慢性感染)對(duì)CD3ζ磷酸化的影響。結(jié)果表明: CD3ζ的磷酸化模式在T細(xì)胞耗竭過程中發(fā)生顯著改變——C端的ITAM3的磷酸化衰減速度遠(yuǎn)快于N端的ITAM1,致使細(xì)胞中積累大量“部分磷酸化”的CD3ζ,進(jìn)而引發(fā)TCR信號(hào)不足。該發(fā)現(xiàn)為T細(xì)胞耗竭機(jī)制提供了新解釋:即除了“外在的”免疫檢查點(diǎn)分子(如PD-1、LAG3等)外,“內(nèi)在的”TCR自身的磷酸化不足也是T細(xì)胞功能異常的重要原因。在多種人類腫瘤中,這種信號(hào)衰減與T細(xì)胞耗竭密切相關(guān)。
綜上所述,該研究通過生物物理學(xué)、生物化學(xué)和免疫學(xué)的多學(xué)科交叉,解析了CD3ζ胞內(nèi)區(qū)在生理酸性膜環(huán)境中的動(dòng)態(tài)結(jié)構(gòu),闡明了靜電調(diào)控的ITAM順序磷酸化規(guī)律,揭示了T細(xì)胞耗竭的新機(jī)制,為免疫治療提供了新思路。
值得一提的是,許琛琦團(tuán)隊(duì)和合作者的前期研究發(fā)現(xiàn),正電基序BRS存在于70%的人類單跨膜蛋白,其中包括重要的免疫受體TCR、BCR、CD28、LAG3、PD-L1、IL7R等。這些免疫受體可以結(jié)合不同信號(hào)分子形成近膜靜電調(diào)控網(wǎng)絡(luò),發(fā)揮各種功能(Shi et al., Nat Rev Immunol 2024),包括調(diào)控免疫受體的磷酸化、泛素化、液液相分離、機(jī)械信號(hào)轉(zhuǎn)導(dǎo)等過程。(詳細(xì)內(nèi)容見https://xulab.sibcb.ac.cn/,代表性論文包括Cell 2008, Nature 2013, Cell Res 2017, Nat Struc Mol Biol 2017, Cell 2020, Immunity 2024,Cell 2025等。)本研究中揭示的BRS-lipid靜電相互作用調(diào)控CD3ζ順序磷酸化的新機(jī)制進(jìn)一步完善了近膜靜電網(wǎng)絡(luò)調(diào)控機(jī)制,為人工設(shè)計(jì)免疫受體提供了新理念。
分子細(xì)胞卓越中心許琛琦研究員、中國(guó)科學(xué)院深圳先進(jìn)技術(shù)研究院合成生物學(xué)研究所施小山研究員以及上海科技大學(xué)王皞鵬研究員為該論文的共同通訊作者。分子細(xì)胞卓越中心李華副研究員、孟麗博士、深圳先進(jìn)技術(shù)研究院褚純博士、分子細(xì)胞科學(xué)卓越創(chuàng)新中心李昌庭、楊皓晨為該論文的共同第一作者。該項(xiàng)工作獲得國(guó)家自然科學(xué)基金、科技部、中國(guó)科學(xué)院、上海市科委以及科學(xué)探索獎(jiǎng)、尚思探索學(xué)者基金會(huì)的項(xiàng)目資助,該研究得到分子細(xì)胞卓越中心分子生物學(xué)技術(shù)平臺(tái),蛋白質(zhì)科學(xué)研究(上海)設(shè)施核磁共振系統(tǒng),深圳合成生物研究重大科技基礎(chǔ)設(shè)施和深圳合成生物學(xué)創(chuàng)新研究院公共技術(shù)平臺(tái)提供的技術(shù)支持和協(xié)助。
文章鏈接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(25)00746-4
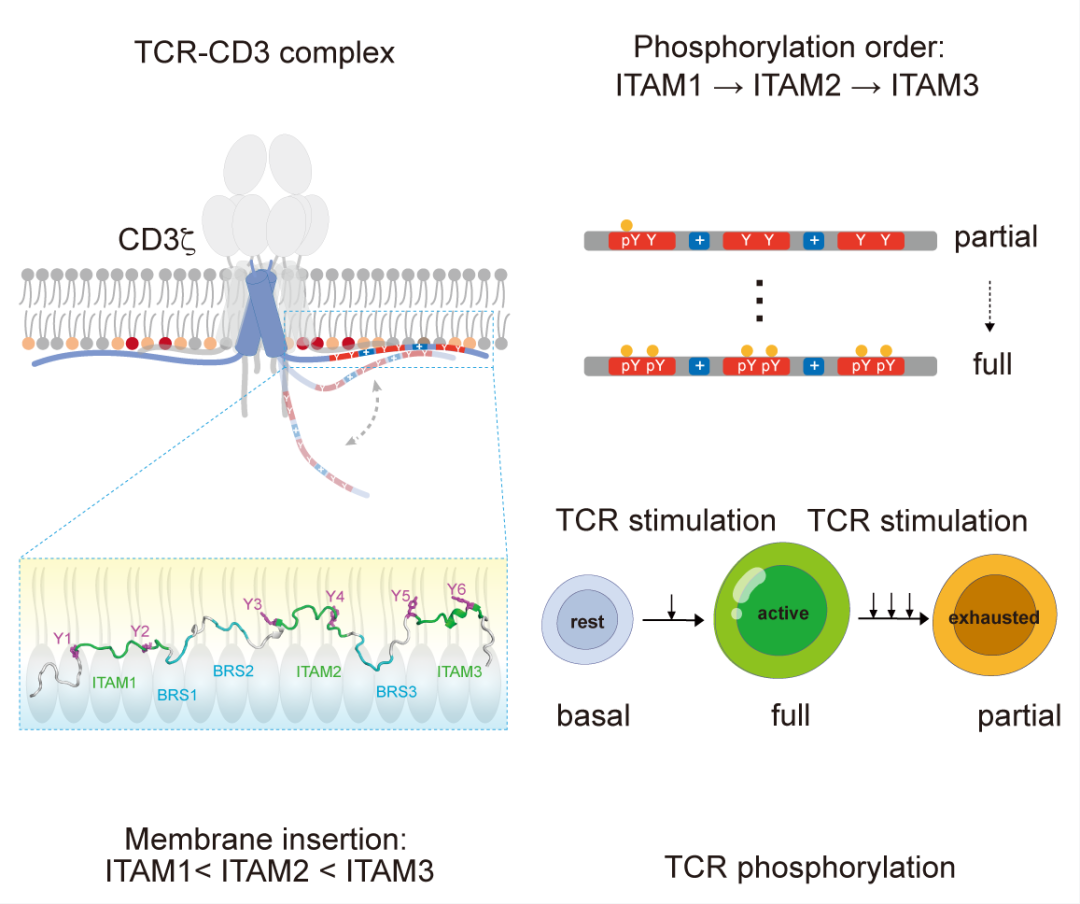
?CD3ζ信號(hào)區(qū)的膜結(jié)合結(jié)構(gòu)及其磷酸化層級(jí)性

該論文被選為封面故事:六孔長(zhǎng)笛象征含六個(gè)酪氨酸磷酸化位點(diǎn)的CD3ζ。正如不同的笛子孔位組合可產(chǎn)生各種音調(diào),不同的CD3ζ磷酸化組合也能產(chǎn)生多樣化的信號(hào)輸出,從而決定抗原免疫應(yīng)答的特異性。封面插畫由許琛琦研究組的張雨萌同學(xué)創(chuàng)作。