
分別于1991年、1994年在華東理工大學獲學士、碩士學位,2000年在中科院上海生物化學研究所獲博士學位。分別于2000 -2005年、2005-2006年在美國國家健康研究院癌癥研究所 (National Cancer Institute, NIH)博士后研究、約翰霍浦金斯醫學院遺傳和分子生物學系任研究助理。2006-至今,中科院上海生化細胞所,先后擔任co-PI、RNA研究技術平臺主任、研究組長。入選2013年國家杰出青年科學基金、2017年國家百千萬人才工程等。擔任Journal of Biological Chemistry、Biology of Reproduction等期刊編委、中國生物化學與分子生物學會理事會常務理事及RNA專業委員會副主任。
實驗室的主要興趣在于了解小分子非編碼RNA的功能和作用機制,主要開展piRNA (PIWI-interacting RNA)和miRNA(microRNA)在哺乳動物精子發生、男性不育及腫瘤發生等過程中的功能機制研究。
1. piRNA在哺乳動物精子發生中的功能和機制
生殖系細胞擔負著遺傳信息的世代傳遞,其基因組的完整性對個體和物種維持都至關重要。真核生物基因組中存在著大量外來入侵的轉座子、逆轉座子等移動性遺傳元件,如轉座元件和它們的化石序列就分別占了人和小鼠基因組的46%和39%,這些自私型遺傳元件是引發基因組DNA突變、導致基因組不穩定的主要因素。piRNA是繼miRNA之后、于2006年7月發現的一類動物生殖細胞特異性小分子非編碼RNA,其大小在26-32核苷酸之間。生殖細胞特異性表達的PIWI家族蛋白是piRNA作用途徑的中心,為piRNA生物生成及功能所必需。小鼠PIWI家族包括MILI、MIWI和MIWI2三個成員,特異性地在睪丸中表達,對小鼠精子發生至關重要。目前認為,piRNA途徑可能是動物生殖細胞進化獲得的一個獨特的對抗外來入侵遺傳元件、維持自身基因組穩定和完整的作用通路,推測piRNA可能在表觀遺傳水平和轉錄后水平沉默轉座子、逆轉座子等DNA移動元件。PIWI蛋白與piRNA結合形成RNA調控復合物除了用于沉默轉座子,在生殖細胞是否還發揮其它功能及其與男性不育的聯系長期不清。
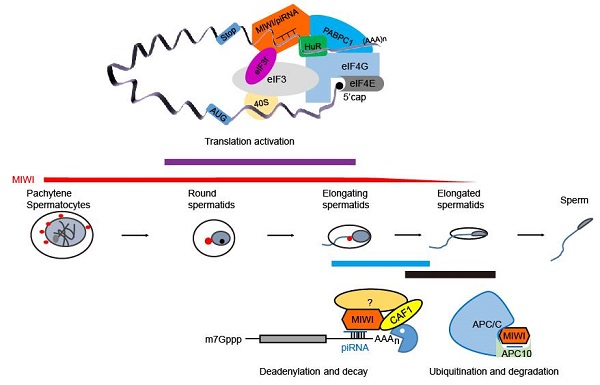
我們實驗室主要以小鼠為模式動物,結合臨床男性不育癥患者樣本分析,關注PIWI/piRNA沉默轉座元件以外的功能機制及其異常調控對男性生殖的影響,取得的主要進展包括:(1)揭示了PIWI/piRNA降解調控機制及功能:小鼠piRNA在精子形成后期觸發其結合蛋白PIWI(MIWI)經APC/C-泛素化降解的新途徑和piRNA誘導PIWI降解的新功能,揭示piRNA與MIWI蛋白以協同模式在精子形成后期被共同清除、piRNA作為“配體”調控其結合蛋白泛素化修飾的新機制,并提供了一種新型的蛋白泛素化降解調控模式(Dev Cell 2013);在無精癥患者中發現了一類拮抗人PIWI(HIWI)蛋白泛素化修飾和降解的突變,并通過小鼠模型證明此類突變足以導致雄性不育,進一步揭示此類突變使得PIWI蛋白在后期精子細胞中異常穩定,進而致使與其相互作用的組蛋白泛素連接酶RNF8被扣留胞質、不能入核泛素化修飾組蛋白,從而阻礙了精子變形過程中的組蛋白-魚精蛋白交換及精子形成(Cell 2017);近期還從男性不育患者中鑒定到piRNA加工酶PNLDC1基因突變,通過小鼠模型證明此突變為男性不育病因,并發現此突變致該加工酶活性顯著降低、piRNA加工成熟受阻(NEJM 2022)。(2)發現MIWI/piRNA對精子細胞中mRNA具有雙重調控作用:在較早期小鼠精子細胞中,MIWI/piRNA通過與翻譯起始因子eIF3f及AU-rich元件結合蛋白HuR等相互作用,激活精子細胞中部分mRNA的翻譯、調控精子細胞發育和精子形成,該發現為精子形成過程中的“轉錄-翻譯”解偶聯提供了新調控機制(Cell 2019);在后期精子細胞中,MIWI/piRNA則與其結合蛋白和脫腺苷酶CAF1組成pi-RISC復合物,指導精子細胞中mRNA大規模地脫腺苷酸化及降解,同時還發現MIWI/piRNA還可以類似siRNA的機制,直接介導部分睪丸mRNA的切割,這些發現提供了精子發生后期父本mRNA清除的一種重要分子機制,并揭示了piRNA在哺乳動物精子發育中的新功能(Cell Res 2014;Cell Res 2015);近期還發現,piRNA的 3'尿苷化加尾有助于PIWI/piRNA復合物的穩定性,從而增強其對編碼基因的調控活性(Cell Res 2022)。
此外,研究組還揭示RNA結合蛋白LARP7通過調控U6 snRNA修飾而確保雄性生殖細胞mRNA剪接保真性及精子發生(Mol Cell 2020)、FXR1通過相分離激活精子細胞翻譯確保精子形成和雄性生殖(Science 2022),進一步證明RNA調控在精子發生中具有不可或缺的重要作用。
2. miRNA在癌癥發生中的功能和機制
miRNA是一類大小在22個核苷酸左右的小分子非編碼RNA,主要通過堿基互補配對抑制靶mRNA的翻譯或誘導其降解,在轉錄后水平負調控基因表達。miRNA家族包含大批癌性基因或抑癌基因,它們的異常表達可以作為腫瘤臨床診斷、分類、分級甚至預后與治療的指標。慢性炎癥和感染是腫瘤發生的一個關鍵誘因。我們致力于研究miRNA在炎癥相關腫瘤發生中的功能與作用機制,先后發現:(1)miR-155通過抑制socs1發揮致癌作用并成為炎癥-腫瘤發生之間的橋梁(Cancer Res 2010);(2)miR-155通過激活STAT3和抑制miR-143,在轉錄和轉錄后雙重水平調控己糖激酶2(Hk2)并作用為炎癥-腫瘤細胞能量代謝(或Warburg效應)之間的重要介質分子,揭示了miR-155在炎癥相關腫瘤發生中的重要作用(EMBO J 2012);(3)癌細胞中的miR-155響應炎癥信號,不僅調控多種癌相關編碼基因的表達,還通過靶向抑制2個miRNA基因的關鍵轉錄因子、調控一系列癌相關miRNA,協奏了癌細胞中的miRNA表達譜(Cell Res 2014);(4)在非小細胞肺癌(NSCLC)患者血清中劇烈升高的促炎性細胞因子IL-1b,通過抑制miR-101表達、解除miR-101對致癌性RNA結合蛋白Lin28B的靶向性抑制,在NSCLC細胞中發揮促癌作用,為促癌性炎癥致肺癌發生提供了新的分子機制(Cancer Res 2014);(5)缺氧劇烈增加HuR和Pri-miR-199a的結合,抑制了miR-199a的加工成熟,而miR-199a通過靶向己糖激酶2(Hk2)和丙酮酸激酶2(Pkm2)這兩個癌細胞關鍵糖酵解基因,抑制肝癌細胞的糖代謝,揭示了缺氧促進癌細胞糖酵解的新機制,并為靶向肝癌腫瘤糖酵解和腫瘤生長提供了新的潛在藥靶分子(EMBO J 2015);(6)miR-155在轉錄和轉錄后雙重水平抑制乳腺癌重要癌基因ErbB2表達,并抑制ErbB2誘導的乳腺上皮細胞惡性轉化(Oncogene 2016);(7)KRAS信號誘導的miR-489表達抑制對致癌性KRAS突變促進胰腺癌細胞轉移至關重要(Cancer Res 2017)。我們的研究結果對了解炎癥相關腫瘤的發生機制及腫瘤細胞代謝調控具有重要意義。此外,我們還發現抗惡性間皮瘤罕見病藥物(orphan drug)—Onconase通過靶向miRNA前體抑制miRNA表達,揭示了一種Onconase抗腫瘤活性的新機制(Cell Res 2012)。
此外,近期研究還發現在腫瘤中異常表達的人PIWIL1(HIWI)通過激活泛素連接酶APC/C促進胰腺癌轉移(Nat Cell Biol 2020)。
研究組目前有成員20人,其中工作人員5人、博士后3人。研究組朝氣蓬勃,學術氣氛積極向上,致力于成為 “獻身,求實,團結,奮進”的非編碼RNA研究團隊。
[*通訊作者]

合影