
1994年被批準為博導,1993年特聘為研究員,1989年被破格晉升為副研究員,1983年在中科院原上海生化所研究生畢業并獲碩士學位,1979年畢業于北京大學生物系生化專業。曾在美國Dartmouth醫學院先1年、后多次短期合作研究(Visiting Scientist,1993-1994、1998、2000、2002)和美國New Jersey-UMDNJ從事研究2年(Research Associate, 1986-1988)。
2000年至今在中科院上海生科院生化與細胞所、現為中科院上海生化與細胞所從事研究,首任所長(2000-2003)、研究組長、博導、研究員、學位委員(2000-2014)和學術委員。曾在中科院原上海生化所從事研究(1983-2000),任所長(1997-2000)、常務副所長(1995-1997,法人代表主持工作)、學術委員會主任(1995-2000)、研究組長(1991-2000)、博導(1994-2000)、研究員(1993-2000)、學術委員(1992-2000)、學位委員(1992-2000)、副研究員(1989-1993)。
兼任:國家基金委生命科學部第七-六屆咨詢委員會委員(2014-2020),國家基金委2個重大研究計劃專家組(細胞器專家組成員2017-2025、RNA專家組副組長2014-2022),中國生化與分子生物學會脂蛋白專業委員會的副主任(2009-)、常務委員(2006-),Acta Biochim Biophys Sin,主編(2006-)、副主編(2002-2006)、常務編委(1996-),《中國生物化學與分子生物學報》副主編(2011-)、常務編委(2011-)、編委(2004-2010),《生命的化學》副主編(2002-)、常務編委(2002-)、編委(1998-2002)。曾兼任:中國生化與分子生物學會基因專業委員會主任(2005-2015),中國生化與分子生物學會第10屆常務理事(2009-2014)、第8屆副理事長兼秘書長(2001-2005)、第7屆副理事長(1997-2001),上海市生化與分子生物學會連續3屆理事(1992-2003),中國生物工程學會第4屆理事(2005-2009)、第3屆常務理事(2001-2005)、第2屆理事(1997-2001),上海市生物工程學會第3屆常務理事(2002-2006)、第2屆理事(1999-2002),中科院生命科學/微觀生物學(1997-2003)、生物技術(1996-2003)和國際合作(1996-2003)的3個專家委員會委員,《Cell Research》編委(2002-2006),《科學通報》特邀編委(2001-2008),中科院上海生科院的黨委書記(2002-2004)和學術委員會常務委員(1999-2006),上海交通大學教授(1997-2000),1998年被聘中國醫科院醫學生物學研究所教授,1994年被聘浙江大學教授。
對科研工作的追求:盡興選擇、反復論證有基礎積累的前沿性課題,即時創造、精細掌握項目課題研究所需要的技術方法,縱深拓寬、交叉運用所學知識于研究實驗分析,細致觀察、實驗解決研究進程所遇關鍵性問題,及時調整、不斷實驗有針對性的研究思路,善于總結、科學表達大量實驗所獲得的數據結果,創建系統、多方協作以促進突破,嚴謹踏實、奮進提升科學研究素質及其智慧品位和社會責任。至今,主持或合作負責完成研究含國家基礎研究重大計劃項目(首席專家)、國家"863"高技術項目、國家"973"項目的課題、國家基金委重大項目的課題與面上項目、中國科學院重大項目和重要方向項目、上海市基礎研究重大重點項目與生物醫藥重點項目等;發表研究論文110多篇、綜述專著20多篇,其中在Nature、Nat Cell Biol、Cell Metab、Cell Res、J Mol Cell Biol、J Lipid Res、J Biol Chem、Acta Biochim Biophys Sin等學術期刊發表通訊或共同通訊作者研究論文60多篇;發明專利已授權13項、申請中10項;獲2016年中國科學十大進展和中國生命科學領域十大進展、1990年中科院十大科技成果;獲國家科技進步二等獎1項、中科院自然科學二等獎1項、中科院科技進步一二等獎各1項和三等獎2項、衛生部科技進步一等獎1項、江蘇省科技進步三等獎1項、上海市科技進步二等獎1項;獲1994年首屆國家杰青、國家"863"和"七五"攻關研究突出貢獻表彰、中科院突出貢獻中青年科學家、上海市優秀專業技術人才、香港求是科技基金會杰出青年學者等;1994年獲國務院政府特殊津貼。
對研究生、博士后及進修人員的寄語:一旦選擇科研并踏上這條崎嶇之路,就要能動地盡快適應這樣的環境,從大量基本事情獨立起步你的研究,不斷實驗、不斷失敗、不斷學習、不斷調整、不斷重復、不斷總結等等,無論如何要煉硬身心、要鼓足精力、要勇于開拓、要積極進取、要嚴謹踏實、要互助合作等等,直至實現勤悟巧進。至今,指導博士后5名,帶博士生25名、碩士生28名(成為PI的10名,獲中國科學院院長特別獎2名、獲中國科學院院長優秀獎2名、獲中國科學院地奧獎3名、獲研究所所長獎11人次);獲得1999年中科院優秀博士生導師獎、1997年中科院上海分院優秀博士生導師獎。
實驗室一直從事生化、分子生物學等方面工作,研究方向先為基因的表達功能、后聚焦于固醇代謝平衡?生理病理調控?靶標系統創建,主要圍繞膽固醇代謝關鍵酶表達功能和固醇轉運調控,長期與美國Dartmouth醫學院TY Chang教授合作,著重研究細胞膽固醇代謝平衡關鍵酶--酰基輔酶A:膽固醇酰基轉移酶(ACAT)的表達功能,探索ACAT的基因結構、轉錄剪接、翻譯修飾、表達調控、功能模式及其與膽固醇代謝平衡的生理功能、病理變化等關系,包括與細胞質膜游離膽固醇的動態平衡、細胞膽固醇及其代謝物固醇的載運特異脂蛋白分泌外排和轉運調控、動脈粥樣硬化(AS)病(如冠心病、中風)、神經退行性疾病(如老年癡呆癥,AD)、癌癥(如肝癌,HCC)等關系,深入ACAT靶標系統創建及新藥研發等,取得了系統性前沿原創成果。
ACAT是細胞內唯一催化游離膽固醇與長鏈脂肪酸生成膽固醇酯的酶,是膽固醇代謝平衡的關鍵酶,對細胞生命、細胞命運與細胞活動發揮極重要的功能作用。ACAT家族有ACAT1和ACAT2,ACAT1在人體所有組織細胞中表達,而ACAT2具有細胞、發育、種族特異性高/低水平表達。
一、ACAT表達功能及固醇轉運調控
在前期研究基礎上,加強與相關基礎領域、醫藥臨床等方面的合作研究,涉及主要內容為ACAT1基因表達的新型反式剪接及其與膽固醇代謝平衡等關系、ACAT2肝腸細胞特異表達及其與肝癌的關系、ACAT1/2單核-巨噬細胞表達協同效應、ACAT表達與細胞質膜膽固醇動態平衡及其對細胞生命/細胞命運/細胞活動的影響、ACAT表達功能相關的網絡調控等,旨在構建前沿研究體系、不斷揭示ACAT表達與功能機制、發現膽固醇代謝關聯的生理功能與病變機理。
Fig. 1 簡要總結我們研究人ACAT1進展的概況與重點,已在國際有影響力學術期刊上發表通訊或共同通訊作者研究論文10多篇,發明專利獲授權的5項、申請中的8項。主要工作是:發現ACAT1調控免疫殺傷 T 細胞的抗腫瘤活性和創建基于膽固醇代謝的抗腫瘤新方法(Nature, 2016),該工作被評為2016年中國科學十大進展、中國生命科學領域十大進展;發現ACAT1引起APP-alpha加工變化,提出ACAT1調控細胞質膜游離膽固醇動態模型(ABBS, 2015);發現ACAT1 56-kD蛋白來源于內-外源性反式剪接的mRNA翻譯,提出相應的內-外源性反式剪接模型(Cell Res, 2013),對生命體的共生學說具有重要意義和補充該反式剪接模型進教科書;發現miR-9降低THP-1來源巨噬細胞的ACAT1活性和抑制泡沫細胞形成(ABBS, 2013);發現TNF-alpha可直接上調分化中單核細胞的ACAT1表達而促進泡沫細胞形成(JLR,2009);揭示人ACAT1 mRNA 的5'非翻譯區通過促進其mRNA快速降解影響蛋白翻譯產生(ABBS, 2009);揭示人ACAT1 56-kD蛋白產生需要其mRNA 跨染色體區域的RNA莖環結構(Cell Res, 2008);發現來自兩條染色體、反式剪接成熟的人ACAT1 mRNA翻譯一種56-kD異構體酶(JBC, 2004);發現糖皮質激素地塞米松(Dex)促進泡沫細胞形成,揭示Dex增強人ACAT1基因表達的分子機制 (Cell Res, 2004);發現人ACAT1 mRNA 5'-ORF-AUG上游穩定莖環結構具有增強選擇下游起始密碼子翻譯的功能作用(ABBS, 2004);揭示干擾素-gamma與ATRA作用人單核細胞而協同調控人ACAT1基因P1啟動子的轉錄活性(JBC, 2001)。
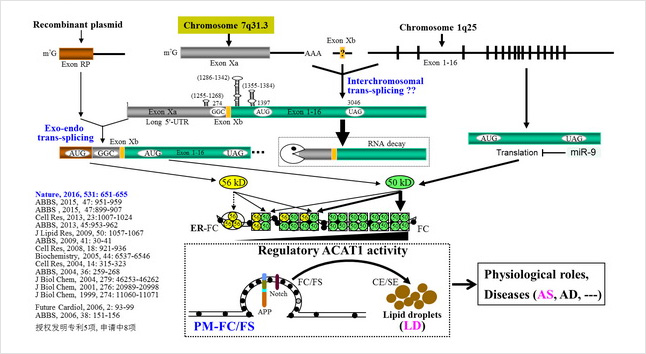
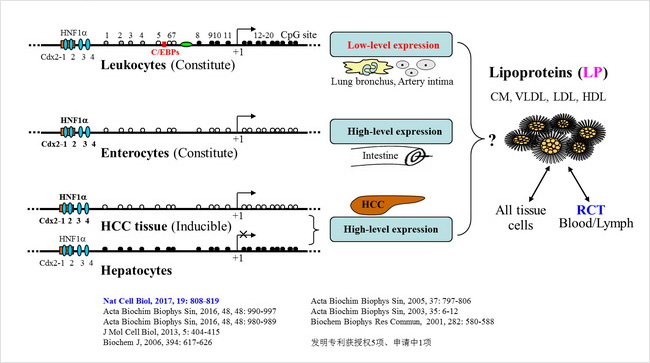
Fig. 2 簡要總結我們研究人ACAT2進展的概況與重點,已在國際有影響力學術期刊上發表通訊或共同通訊作者研究論文近10篇,發明專利獲授權的5項、申請中的1項。主要工作是:發現ACAT2的Cys277泛素化修飾-氧化競爭機制和膽固醇、脂肪酸調控ACAT2蛋白穩定及其抗糖尿病作用(Nat Cell Biol, 2017),緊密關聯能量代謝ROS效應;發現人白細胞低水平表達ACAT2與特異脂蛋白分泌外排(ABBS, 2016b);發現轉錄因子C/EBP調控單核類細胞ACAT2低水平表達(ABBS, 2016a);發現肝癌誘導高水平表達ACAT2消除肝外全身來源累積的極毒性膽固醇代謝物(J Mol Cell Biol, 2013),用于創新研發治療肝癌的特效藥;揭示轉錄因子Cdx2、HNF-1alpha協同調控ACAT2基因的細胞特異和腸細胞分化依賴性表達機制,發現肝癌組織異常高表達ACAT2而可成為特異性診斷標記分子(Biochem J, 2006);發現人ACAT2基因表達的可變性剪接成熟mRNAs及其翻譯產生具有不同酶活性異構體(ABBS, 2005);揭示人ACAT2基因的組織結構和啟動子序列,發現人ACAT2基因啟動子具有細胞特異和腸細胞分化依賴的轉錄活性(BBRC, 2001)。
二、ACAT靶標系統創建及新藥研發
在ACAT前沿研究的積累基礎上深入探索與HCC、AD、AS等緊密關聯的靶標系統,包括針對調控人Acat1/2表達的特異性順式元件(SGNE、ABE、HCE等)創建用于規模性篩選小分子化合物系統、創建細胞ACAT1/2活性直接測定的技術方法系統、創建規模性檢測高選擇性人ACAT抑制劑活性分析的細胞模型系統等。
Fig. 3簡要總結人ACAT1/2的主要細胞水平功能與相應靶標系統。在ACAT靶標系統創建及新藥研發中,已合作研發高選擇性ACAT2的特異抑制劑 (Org Biomol Chem, 2016)并在申請國內外發明專利;已創建可規模性測定組織細胞水平分泌外排LP的ACAT2酶活性及其用于篩選具有抑制的活性小分子化合物等技術方法體系;在深入創建相近于人膽固醇代謝小鼠等模型動物中。這些為相關新藥研發等奠定厚實基礎。
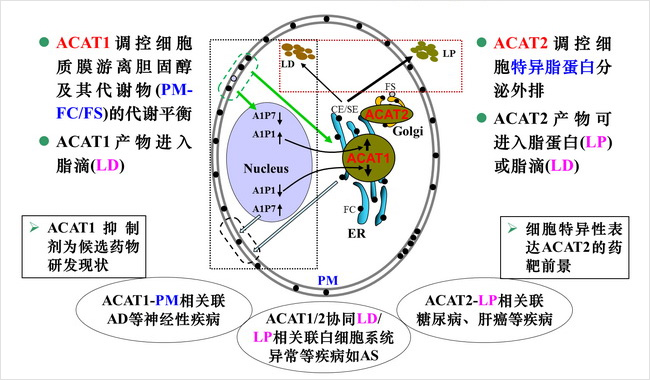
我們實驗室在已有的系統性前沿研究積累基礎上,針對ACAT的底物具有3-beta羥基的游離固醇(FS)和產物固醇酯(SE),結合LC-MS/MS等儀器分析,試創建準確測定細胞質膜游離固醇(PM-FS)、白細胞分泌外排的特異性脂蛋白eLDL及其載運的固醇組分等技術方法體系,確保深入研究ACAT表達功能的同時、進一步拓展探索ACAT對PM-FS和轉運固醇脂蛋白(LP)的動態平衡調控、特別興趣構建白細胞ACAT1/2協調活性的靶標系統創建等,旨在完善更完整的前沿研究體系,不斷揭示ACAT的表達功能機制、發現固醇代謝關聯的生理功能、病變機理,形成更有特色系統工作,為相關的HCC、AD、AS等疾病的預防、診治、藥物研究提供理論依據和重要基礎,促進轉化應用與人類健康。

合影