
許琛琦,研究員,1998年于華東師范大學(xué)獲得生物化學(xué)專業(yè)學(xué)士,2004年于中科院生化細(xì)胞所獲得生物化學(xué)與分子生物學(xué)博士學(xué)位,2004-2009年于哈佛大學(xué)Dana-Farber腫瘤研究所從事博士后研究,獲得Arthritis Foundation資助,后晉升為Instructor。2009年底加入中科院生化與細(xì)胞所,入選國家基金杰出青年基金。闡明了抗原免疫應(yīng)答調(diào)控的新機(jī)制并發(fā)展了腫瘤免疫治療的新策略。工作已發(fā)表于Cell 2020, Nature 2018,Nature 2016,Nature 2013等,兩項(xiàng)成果入選中國科學(xué)十大進(jìn)展/中國生命科學(xué)十大進(jìn)展,其發(fā)明專利已成功進(jìn)入轉(zhuǎn)化。榮獲上海市青年科技杰出貢獻(xiàn)獎(jiǎng)(2020年),中國青年科技獎(jiǎng)(2018年),中國生化與分子生物學(xué)會(huì)Promega生物化學(xué)獎(jiǎng)(2018年)等榮譽(yù)。
免疫系統(tǒng)是機(jī)體執(zhí)行免疫應(yīng)答及免疫功能的重要系統(tǒng),它能夠區(qū)分“自身”和“非自身”,并通過清除“非自身物質(zhì)”來保護(hù)機(jī)體。免疫系統(tǒng)可以分為固有免疫和適應(yīng)性免疫。固有免疫系統(tǒng)在低等動(dòng)物中就開始出現(xiàn),可以識(shí)別病原體所攜帶的特殊模式以及體內(nèi)的危險(xiǎn)信號(hào),從而迅速地做出免疫反應(yīng)。適應(yīng)性免疫系統(tǒng)是高等動(dòng)物逐漸進(jìn)化出的特殊功能系統(tǒng),最大的特點(diǎn)是能夠針對(duì)不同的抗原做出高度特異性和靈敏性的免疫反應(yīng)。T淋巴細(xì)胞(簡稱T細(xì)胞)是適應(yīng)性免疫系統(tǒng)的主要功能細(xì)胞,在清除病原體和腫瘤細(xì)胞過程中發(fā)揮著至關(guān)重要的作用。T細(xì)胞的活性異常與腫瘤、自身免疫病等多種重大疾病直接相關(guān)。基于T細(xì)胞功能調(diào)控的腫瘤免疫治療已成為治療腫瘤的主要武器之一,在臨床上已取得了巨大的成功。但現(xiàn)有的基于信號(hào)轉(zhuǎn)導(dǎo)調(diào)控的腫瘤免疫治療手段只對(duì)部分病人有效,因此急需發(fā)展新的方法讓更多的病人受益。本研究組交叉利用免疫學(xué)、生物化學(xué)、生物物理學(xué)前沿手段,著力于T細(xì)胞活性調(diào)控的分子機(jī)制研究,揭示了T細(xì)胞發(fā)揮免疫功能的分子基礎(chǔ),并且發(fā)展了新的腫瘤免疫治療方法。
1. 抗原免疫應(yīng)答的調(diào)控機(jī)制
抗原免疫應(yīng)答過程涉及多種免疫受體的協(xié)同作用。本課題組對(duì)抗原受體TCR,共刺激受體CD28和共抑制受體PD-1的活化機(jī)制做了深入而系統(tǒng)的研究,我們創(chuàng)新性地提出了“膜脂調(diào)控”理論,指出酸性磷脂可以通過靜電相互作用調(diào)控免疫受體的活化過程。
T細(xì)胞的活化主要依賴于抗原受體TCR(T-cell receptor)和共刺激受體CD28。我們的前期研究表明TCR的活性受酸性磷脂調(diào)控。帶負(fù)電的酸性磷脂可以和帶正電的TCR胞內(nèi)區(qū)動(dòng)態(tài)結(jié)合,從而將TCR的磷酸化位點(diǎn)屏蔽在膜內(nèi),保證TCR在靜息態(tài)T細(xì)胞中處于功能關(guān)閉狀態(tài)(Cell 2008)。我們隨后發(fā)現(xiàn)TCR初始信號(hào)引發(fā)的鈣離子內(nèi)流能夠反饋調(diào)控TCR。Ca2+可以直接結(jié)合酸性磷脂的磷酸根,中和其攜帶的負(fù)電荷,從而打破TCR與酸性磷脂之間的靜電相互作用,促進(jìn)TCR功能位點(diǎn)的解屏蔽及磷酸化,從而放大TCR的活化信號(hào)(Nature 2013)。這一新的分子機(jī)制突破了以往對(duì)Ca2+功能的傳統(tǒng)認(rèn)識(shí)。在這項(xiàng)工作基礎(chǔ)上,我們進(jìn)一步發(fā)現(xiàn)Ca2+的正反饋調(diào)控還適用于CD28。酸性磷脂同樣可以屏蔽CD28的磷酸化位點(diǎn),而Ca2+也能夠通過中和酸性磷脂負(fù)電荷的機(jī)制來放大CD28信號(hào)(Nature Structural & Molecular Biology 2017)。我們由此提出TCR,Ca2+,CD28這三者之間組成了一個(gè)雙環(huán)路的正反饋網(wǎng)絡(luò),可以將微弱的初始抗原刺激信號(hào)迅速放大,使T細(xì)胞獲得完全的效應(yīng)功能,從而為T細(xì)胞高靈敏性提供了信號(hào)基礎(chǔ)(圖1)。“膜脂調(diào)控”理論在我們的合作研究中同樣被證明適用于多種免疫受體,比如鈣離子在記憶型B細(xì)胞的迅速活化過程中也起到關(guān)鍵的作用(Nature Communications 2015,The Journal of Physical Chemistry Letters, 2017)。我們也撰寫了多篇綜述來闡述這個(gè)學(xué)術(shù)思想(Trends Biochem Sci 2014, Trends Immunol 2016, Nat Rev Immunol 2016)。
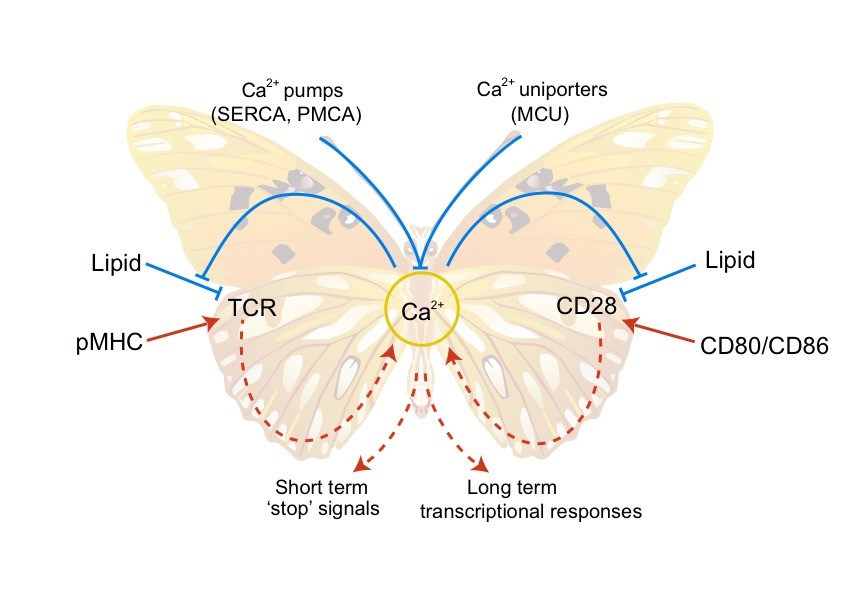
圖1. TCR-Ca2+-CD28雙環(huán)路正反饋模型。T細(xì)胞活化主要依賴TCR和CD28。這兩個(gè)關(guān)鍵受體的磷酸化位點(diǎn)都被酸性磷脂通過靜電效應(yīng)屏蔽,而Ca2+可以通過中和酸性磷脂負(fù)電荷的形式釋放受體磷酸化位點(diǎn),促進(jìn)受體活化。TCR和CD28的活化都能夠誘導(dǎo)Ca2+內(nèi)流。TCR-Ca2+-CD28這三者之間由此形成雙環(huán)路的正反饋網(wǎng)絡(luò),可以將微弱的初始刺激信號(hào)迅速放大,為T細(xì)胞的高抗原敏感性提供信號(hào)基礎(chǔ)。
我們還發(fā)現(xiàn)TCR的結(jié)構(gòu)多態(tài)性和酪氨酸激酶Lck的底物選擇性是T細(xì)胞高特異性的分子基礎(chǔ)。通過單分子技術(shù)和液相核磁共振技術(shù),我們發(fā)現(xiàn)TCR在不同的抗原刺激下會(huì)產(chǎn)生不一樣的開放性構(gòu)象,從而對(duì)Lck激酶有不同程度的招募;隨后Lck對(duì)TCR上的多個(gè)酪氨酸位點(diǎn)進(jìn)行選擇性磷酸化,產(chǎn)生抗原特異性的磷酸化模式并引發(fā)不同的T細(xì)胞效應(yīng)功能(圖2,Cell Research 2017,PNAS 2017)。
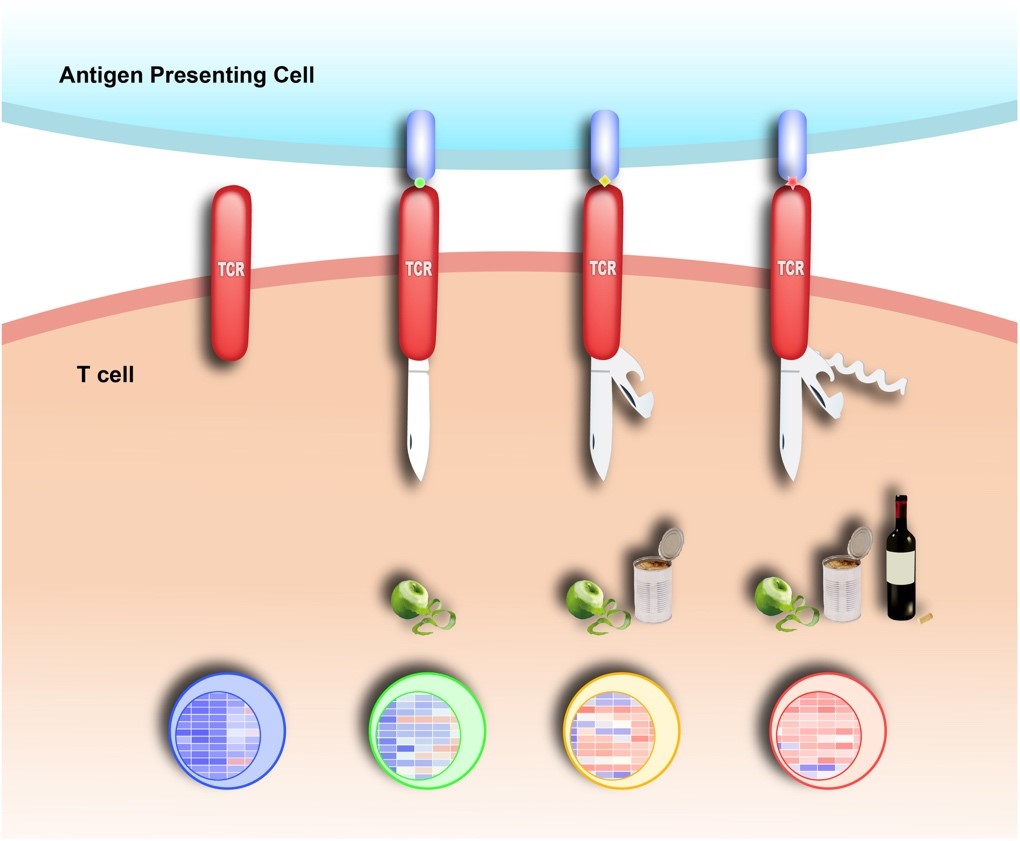
圖2. TCR結(jié)構(gòu)多態(tài)性模型。TCR可以在不同抗原刺激下產(chǎn)生不同的開放性構(gòu)象,從而引發(fā)特異性的下游信號(hào)通路,使得T細(xì)胞獲得不同的效應(yīng)功能。這個(gè)模型解釋了T細(xì)胞獲得抗原特異性的信號(hào)基礎(chǔ)。
我們同樣研究了T細(xì)胞的共抑制受體PD-1。T細(xì)胞在腫瘤微環(huán)境中會(huì)表現(xiàn)出功能耗竭的狀態(tài),并伴隨著PD-1的異常高表達(dá)。目前在臨床上應(yīng)用的PD-1或PD-L1抗體就是通過阻滯PD-1的抑制性信號(hào),進(jìn)而增強(qiáng)T細(xì)胞的抗腫瘤活性。我們發(fā)現(xiàn)了PD-1的降解機(jī)制及其在抗腫瘤過程中的重要性 (Nature 2018)。活化T細(xì)胞表面的PD-1會(huì)經(jīng)歷內(nèi)吞、泛素化和蛋白酶體的降解等一系列過程。我們找到了介導(dǎo)PD-1泛素化的E3連接酶FBXO38。在Fbxo38條件性敲除的小鼠體內(nèi)腫瘤生長的會(huì)更快,腫瘤浸潤T細(xì)胞的PD-1表達(dá)水平也更高。而PD-1抗體治療有效抑制了FBXO38缺失小鼠體內(nèi)腫瘤的生長,揭示了PD-1是FBXO38作用的直接靶點(diǎn)。FBXO38對(duì)PD-1表達(dá)量的調(diào)控為阻滯PD-1的抑制性信號(hào)提供了一個(gè)新的角度,也為針對(duì)PD-1的抗腫瘤藥物的研發(fā)提供新的思路。
2. 腫瘤免疫治療
近年來,本課題組利用自己在免疫受體和脂質(zhì)調(diào)控方面的基礎(chǔ)知識(shí),提出了全新的腫瘤免疫治療理論及策略。一方面我們認(rèn)為通過調(diào)控T細(xì)胞的代謝狀態(tài)可以讓其獲得更強(qiáng)的效應(yīng)功能。我們發(fā)現(xiàn)膽固醇儲(chǔ)存通路的關(guān)鍵調(diào)節(jié)酶ACAT1是一個(gè)很好的調(diào)控靶點(diǎn),抑制ACAT1的活性可以大大提高CD8+ T細(xì)胞(又名殺傷性T細(xì)胞)的抗腫瘤功能。其機(jī)理是ACAT1被抑制后,殺傷性T細(xì)胞膜上的游離膽固醇水平提高,從而讓TCR的聚集程度和信號(hào)轉(zhuǎn)導(dǎo)能力提高并使得T細(xì)胞的殺傷性免疫突觸形成更加有效。我們進(jìn)一步利用ACAT1的小分子抑制劑Avasimibe在動(dòng)物模型中治療多種腫瘤,發(fā)現(xiàn)該抑制劑具有很好的抗腫瘤效應(yīng);并且Avasimibe與現(xiàn)有的腫瘤免疫治療臨床藥物anti-PD-1聯(lián)用后效果更佳。Avasimibe曾經(jīng)作為心血管疾病的藥物進(jìn)行過三期臨床試驗(yàn),雖然這個(gè)小分子抑制劑對(duì)動(dòng)脈粥樣硬化沒有明顯的治療效果,但是它具有很好的人體安全性,因此Avasimibe具有很好的潛力被開發(fā)成抗腫瘤藥物(Nature 2016,中國生命科學(xué)十大進(jìn)展)。
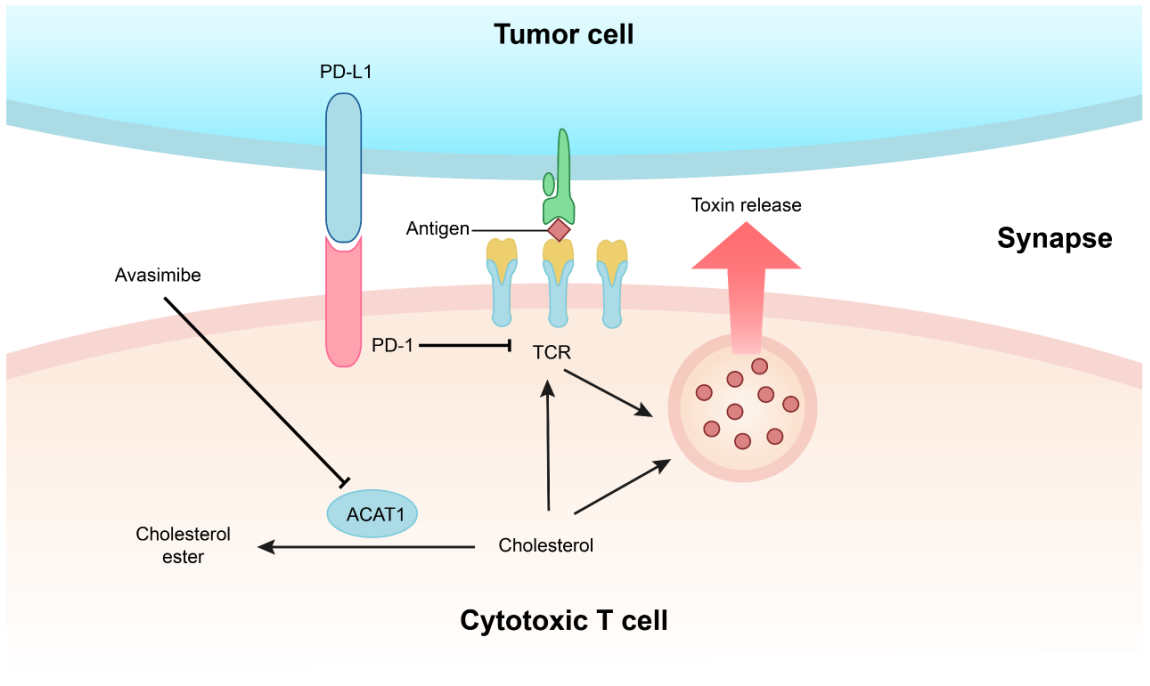
圖3. 基于膽固醇代謝調(diào)控的腫瘤免疫治療新方法。膽固醇酯化酶ACAT1可以將細(xì)胞內(nèi)的游離膽固醇轉(zhuǎn)化為膽固醇酯。抑制CD8+ T細(xì)胞的ACAT1活性可以使細(xì)胞質(zhì)膜的游離膽固醇水平上升,從而使得TCR信號(hào)增強(qiáng)并讓殺傷性免疫突觸更成熟。T細(xì)胞腫瘤抗原免疫應(yīng)答由此變得更加高效。
另一方面我們基于CD3e 蛋白的多重信號(hào)功能發(fā)展了一種新的CAR-T細(xì)胞治療技術(shù),可以提高細(xì)胞的抗腫瘤功能并降低細(xì)胞因子風(fēng)暴的風(fēng)險(xiǎn)。通過建立絕對(duì)定量質(zhì)譜系統(tǒng),我們對(duì)CD3分子內(nèi)的所有酪氨酸位點(diǎn)定量并發(fā)現(xiàn)CD3e ITAM呈現(xiàn)出獨(dú)特的單磷酸化的模式。進(jìn)一步的研究發(fā)現(xiàn),CD3e ITAM可以特異性的招募抑制性激酶Csk來抑制Lck介導(dǎo)的磷酸化過程,表明天然的抗原受體TCR同時(shí)具有活化元件(CD3z)和調(diào)控元件(CD3e),具有信號(hào)自我調(diào)控的能力。目前臨床上使用的CAR-T細(xì)胞,其人工合成的抗原受體CAR卻只利用了CD3z。當(dāng)我們將CD3e加入至臨床上使用的CAR中后,CAR-T細(xì)胞的抗腫瘤能力得到了增強(qiáng)。從機(jī)制的角度來看,CD3e中的ITAM基序可以招募Csk來下調(diào)CAR-T細(xì)胞的細(xì)胞因子的分泌水平,BRS基序可以招募p85進(jìn)而增強(qiáng)CAR-T細(xì)胞的生長持續(xù)性。因此在CAR中加入了CD3e可以引入更豐富的信號(hào)調(diào)控機(jī)制,從而提升CAR-T的整體表現(xiàn),為未來的CAR-T細(xì)胞治療提供新的發(fā)展方向(Cell 2020,中國生命科學(xué)十大進(jìn)展)。
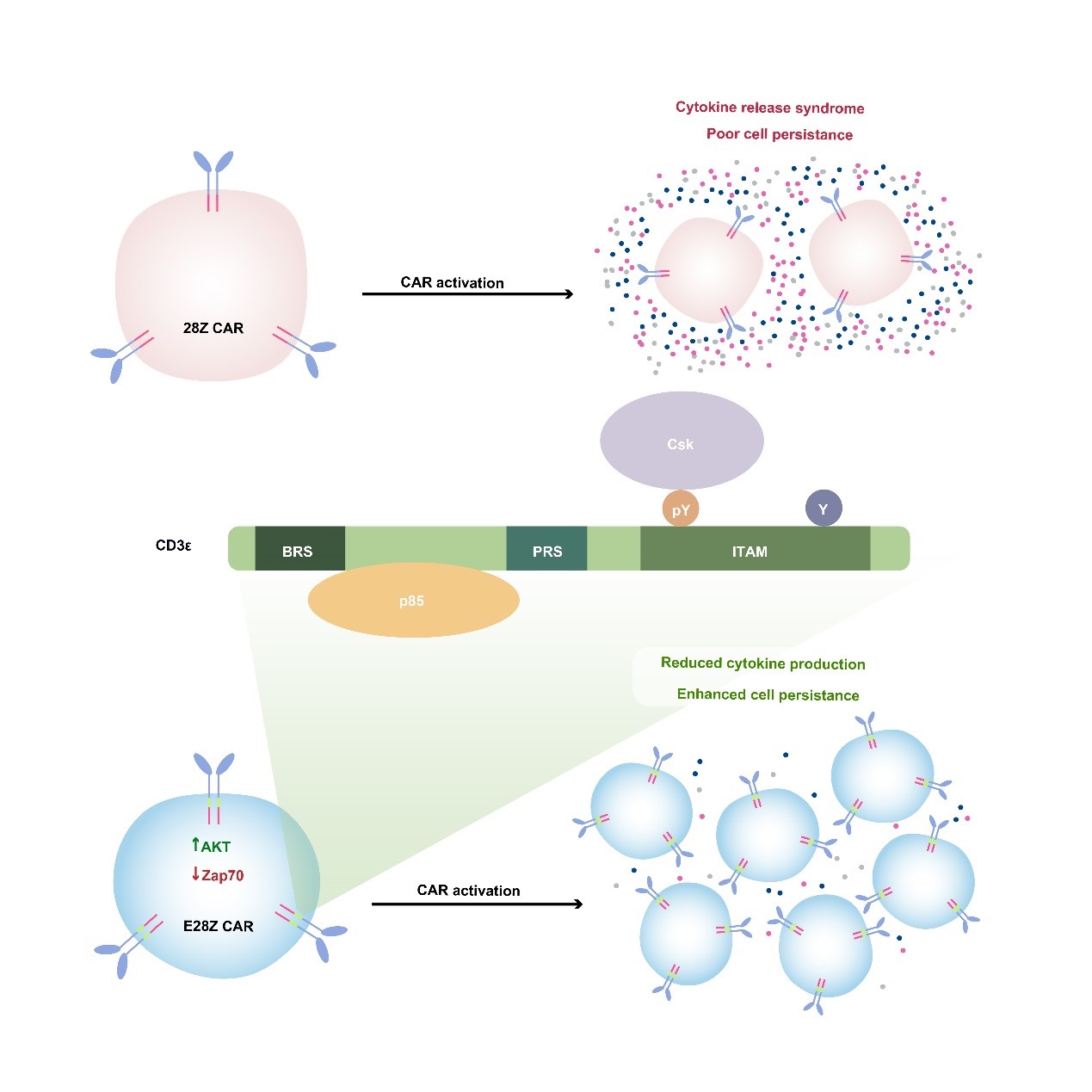
圖4. 基于CD3e 蛋白多重信號(hào)功能而設(shè)計(jì)的新型CAR-T細(xì)胞療法。TCR的CD3e 鏈具有特殊的信號(hào)轉(zhuǎn)導(dǎo)功能,可以同時(shí)招募抑制性分子Csk和活化性分子PI3K。將CD3e 胞內(nèi)區(qū)加入臨床使用的CAR序列中,可使得CAR-T細(xì)胞生長持續(xù)性更好,抗腫瘤功能更強(qiáng),并且細(xì)胞因子釋放綜合癥的風(fēng)險(xiǎn)降低。
綜上所述,本研究組在T細(xì)胞的基礎(chǔ)研究中發(fā)現(xiàn)了T細(xì)胞活化的新分子機(jī)制,同時(shí)在免疫受體信號(hào)和代謝調(diào)控兩個(gè)角度發(fā)展了新的腫瘤免疫治療方法。今后我們將主要研究在不同生理和病理環(huán)境下的T細(xì)胞脂代謝特征,并且尋找新的“代謝檢查點(diǎn)”用于代謝調(diào)控,同時(shí)進(jìn)行CAR-T細(xì)胞的功能機(jī)制研究,為未來CAR-T細(xì)胞的設(shè)計(jì)與臨床應(yīng)用提供新的思路與發(fā)展方向。?

合影